9月16日,美国科学院院刊PNAS杂志在线发表了5357cc拉斯维加斯、药物化学生物学国家重点实验室杨娜课题组与中科院生物物理所许瑞明课题组、范组森课题组的合作研究成果,题为“A higher-order configuration of the heterodimeric DOT1L-AF10 coiled-coil domains potentiates their leukemogenenic activity”。揭示了MLL1-AF10融合蛋白通过AF10的OM-LZ结构域与DOT1L非催化区的Coiled-Coil结构域形成寡聚体,引发急性白血病发生的分子机制。
已知MLL1(Mixed Lineage Leukemia 1)基因的染色体异位与急性淋巴细胞白血病(ALL)和急性髓细胞白血病(AML)的发生密切相关。MLL1蛋白由多个结构域组成,其N端CXXC结构域负责MLL1在基因组上的定位,C端SET结构域催化组蛋白H3K4的甲基化反应。发生染色体易位的MLL1与其他蛋白形成致癌融合蛋白,这些融合蛋白保留了MLL1的N端DNA定位区域,丢失了SET甲基化酶催化结构域,因此可将融合蛋白的功能带到MLL1调节的基因区域。例如MLL1-AF10融合蛋白,可通过AF10(ALL1-Fused gene from chromosome 10)招募组蛋白H3K79位甲基转移酶DOT1L,上调MLL1定位区域组蛋白H3K79位的甲基化水平,造成下游MLL1调控的与白血病相关基因的异常高表达,如MEIS1、HOXA基因簇等,引发白血病的发生。
张毅课题组2005年通过哺乳动物双杂交、免疫共沉淀等实验发现人源AF10通过其OM-LZ(Octapeptide Motif-Leucine Zipper)结构域与DOT1L发生直接的相互作用。并且设计了克隆形成实验,验证了DOT1L与AF10的相互作用、以及DOT1L的甲基化酶活性在MLL1-AF10融合蛋白引发白血病中起到至关重要的作用[1]。DOT1L也是包含多个结构域的蛋白,已知其甲基化酶结构域在N端,许瑞明课题组最先解析了DOT1L独特的非SET结构域的催化机制[2]。然而DOT1L与AF10相互作用的具体部位、相互作用的分子机制仍有待揭示,针对二者相互作用的干扰剂的设计也将为MLL1融合蛋白引发的急性白血病的治疗提供新的线思路。
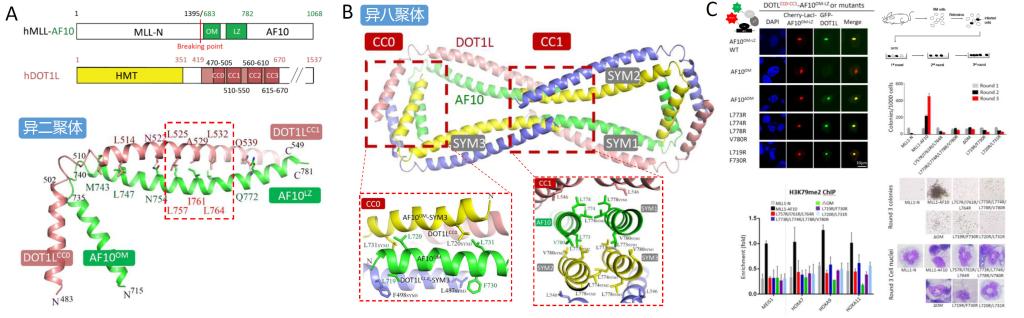
作者首先通过体外共纯化实验确定了人源DOT1L C端4个串联的Coiled Coil结构域(CC0-CC3)是与AF10的OM-LZ结构域相互作用的部位。进一步分析发现尽管CC0-CC1和CC2-CC3分别都与AF10相互作用,但亲和力和形成的寡聚形式都不同。CC0-CC1具有更强的亲和力,并且与AF10OM-LZ形成八聚体的寡聚形式,这与全部4个CC结构域与AF10OM-LZ形成复合物的寡聚形式一致。而CC2-CC3与AF10的结合力较弱,在溶液中也不以八聚体形式存在。加拿大闵金荣课题组分别检测了每个CC结构域与AF10OM-LZ的相互作用,也发现CC1比CC2和CC3对AF10的亲和力强很多,但受结晶条件影响,该工作解析了人源AF10OM-LZ与斑马鱼CC2复合物的结构。
作者进而解析了人源DOT1L的CC0-CC1结构域与AF10OM-LZ复合物的晶体结构。结构分析显示DOT1L-AF10异二聚体的形成主要依赖CC1与LZ之间形成的亮氨酸拉链结构,这与CC2与LZ间的相互作用类似。有意思的是,虽然CC0不与AF10发生直接的相互作用,但与形成八聚体(四个异二聚体)后对称AF10分子的OM结构域发生相互作用。同时,4个AF10LZ结构域的C末端也通过自身相互作用形成四聚体进而稳定异八聚体的形成。突变OM结构域和LZ末端的相应残基,都会影响异八聚体的形成。
作者进一步通过细胞内荧光共定位实验证明了上述异八聚体形成的关键残基不影响DOT1L-AF10之间的相互作用,并通过克隆形成实验、细胞核染色观察等手段验证了DOT1L-AF10复合体的寡聚形式与二者之间的相互作用一样,对白血病细胞的增殖和去分化至关重要。并通过染色质免疫共沉淀、定量PCR等手段,验证了这种寡聚形式对MLL1-AF10招募DOT1L到特定基因区域,进而影响下游白血病相关基因的表达水平发挥的重要影响。
综上,该工作解析了MLL1-AF10致癌融合蛋白招募DOT1L的结构基础和分子机制,发现除了AF10-DOT1L之间的相互作用外,二者形成复合体的寡聚形式同样对MLL1-AF10融合蛋白的致病性起到关键作用。这些结果为基于AF10-DOT1L相互作用和寡聚形式的干扰剂的设计和开发提供了重要依据。
全文链接:https://www.pnas.org/content/early/2019/09/11/1904672116