(通讯员 马岚)5357cc拉斯维加斯杨光副研究员联合东莞理工学院的王晓季教授课题组,于近日在药物化学领域顶级期刊Journal of Medicinal Chemistry(DOI:10.1021/acs.jmedchem.1c00996)上发表文章“Proteolysis Targeting Chimera (PROTAC) Modification of Dovitinib Enhances Antiproliferative Effect against FLT3-ITD Positive Acute Myeloid Leukemia Cells”,并被评为该杂志的封面文章。该研究团队针对第一代FLT3-ITD多靶点激酶抑制剂——多韦替尼(Dovitinib)选择性差,药物使用量大,药物体内蓄积,临床治疗效率较低等缺点,在此基础上通过PROTAC分子的设计原理,优化E3连接酶配体和linker的结构,筛选得到两种对FLT3-ITD突变白血病的治疗有潜力的药物分子。

急性髓系白血病(Acute myeloid leukemia, AML)是一种具有遗传多样性和侵袭性的血液恶性肿瘤,源于未成熟髓系祖细胞分化受阻和无序增殖。Fms相关酪氨酸激酶3(FLT3)是一种在造血细胞上表达的酪氨酸激酶受体。在约30%的急性髓系白血病(AML)病例中发现FLT3的激活突变。该突变导致FLT3构成性激活,从而激活多种细胞内信号分子,如PI3K/AKT、MAPK/ERK,进而促进白血病细胞增殖,抑制细胞凋亡。多项研究表明FLT3-ITD患者复发率高,临床预后差,总生存率低。因此,FLT3-ITD是治疗FLT3-ITD阳性AML的有效靶点。
在过去的十年中,许多药物被开发为有效的FLT3-ITD抑制剂,例如一代的Dovitinib,Sorafenib,Midostuin等,最近,一些相对更具选择性的第二代FLT3-ITD抑制剂,例如Crenolanib,Quizartinib,FF-10101等高选择性的FLT3-ITD分子也在经历不同阶段的临床试验中。然而,大多数患者最初得到缓解,很快出现耐药性和其他的安全问题。为了满足日益增长的AML病人的临床需求,研发更加安全高效的药物分子依然迫在眉睫。除了直接抑制FLT3的激酶活性外,诱导FLT3- ITD降解正成为一种新策略。蛋白质水解靶向嵌合体(PROTACs)技术提供了一个理想的方法。
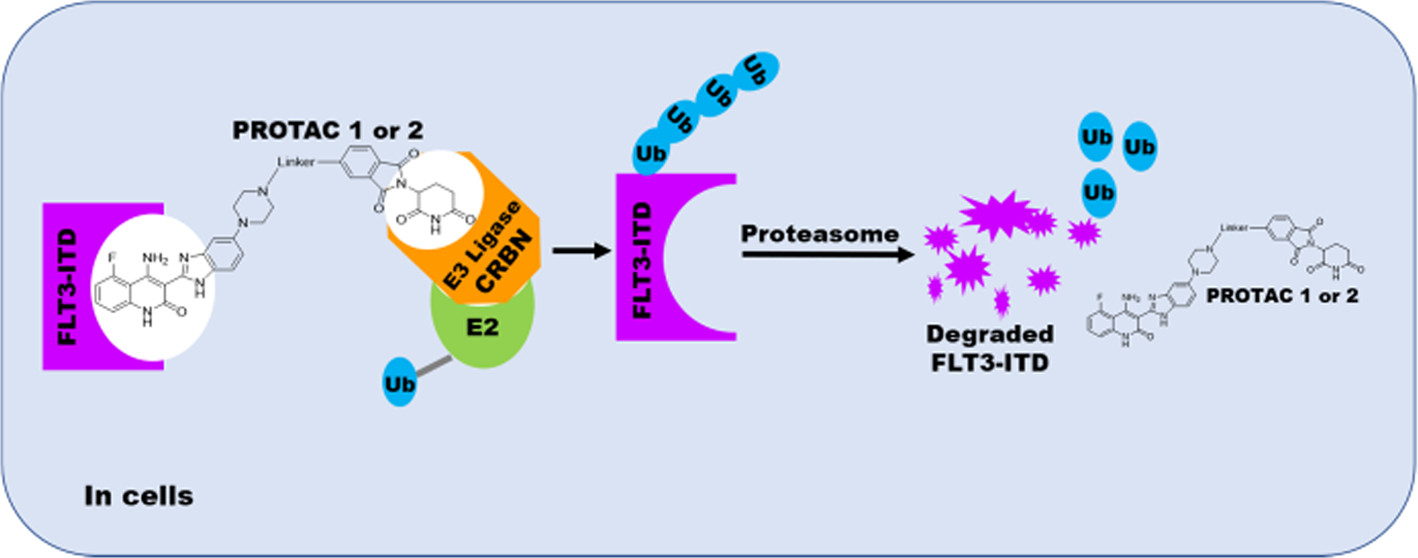
PROTACs设计原理
本研究初步筛选得到两种化合物(1和2)具有显著的抗MOLM-13和MV-4-11细胞(FLT3-ITD+ AML细胞)增殖作用。进一步的生物学评价表明,用药物处理以后,细胞内形成蛋白、PROTAC分子和E3连接酶三元复合体,显著上调FLT3-ITD蛋白的泛素化水平并诱导FLT3-ITD蛋白以泛素-蛋白酶体依赖的方式发生高效的降解,并在低纳摩尔浓度下即可完全阻断其下游信号通路并诱导细胞凋亡。
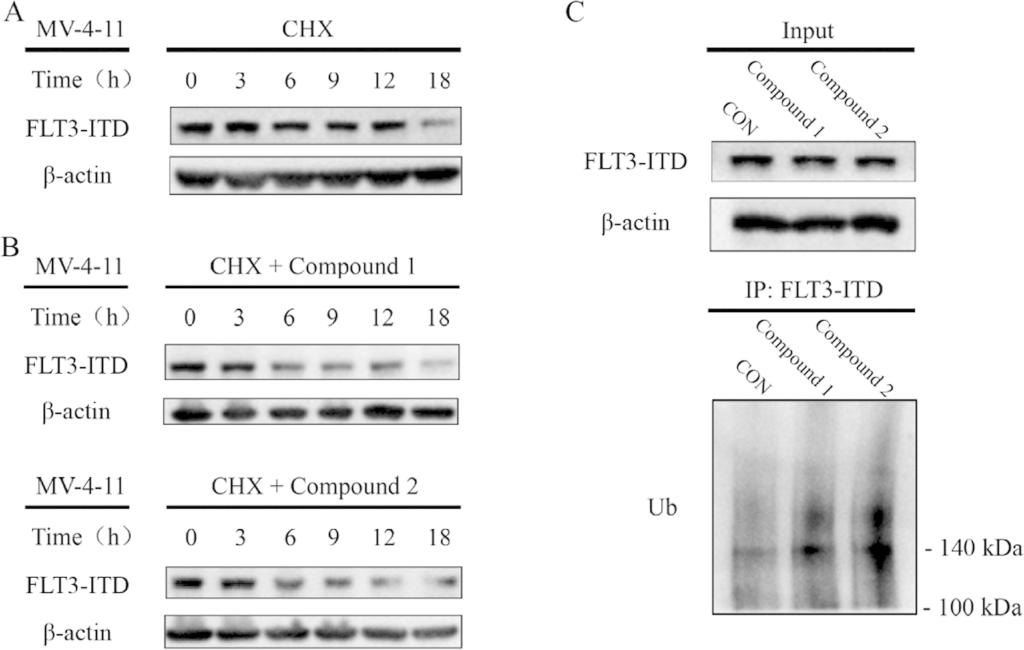
化合物1和2通过泛素-蛋白酶体系统诱导FLT3-ITD蛋白降解
值得一提的是,在小鼠体内肿瘤异种移植评价模型中,我们通过尾静脉注射MV-4-11细胞到全免疫缺陷的小鼠,然后静脉给药化合物1和2(3 mg/Kg),结果显示,化合物1和2显著下调了白血病小鼠中CD45+细胞的数量,药物安全性较好,表明化合物1和2是一种对FLT3-ITD突变白血病的治疗有潜力的药物分子。
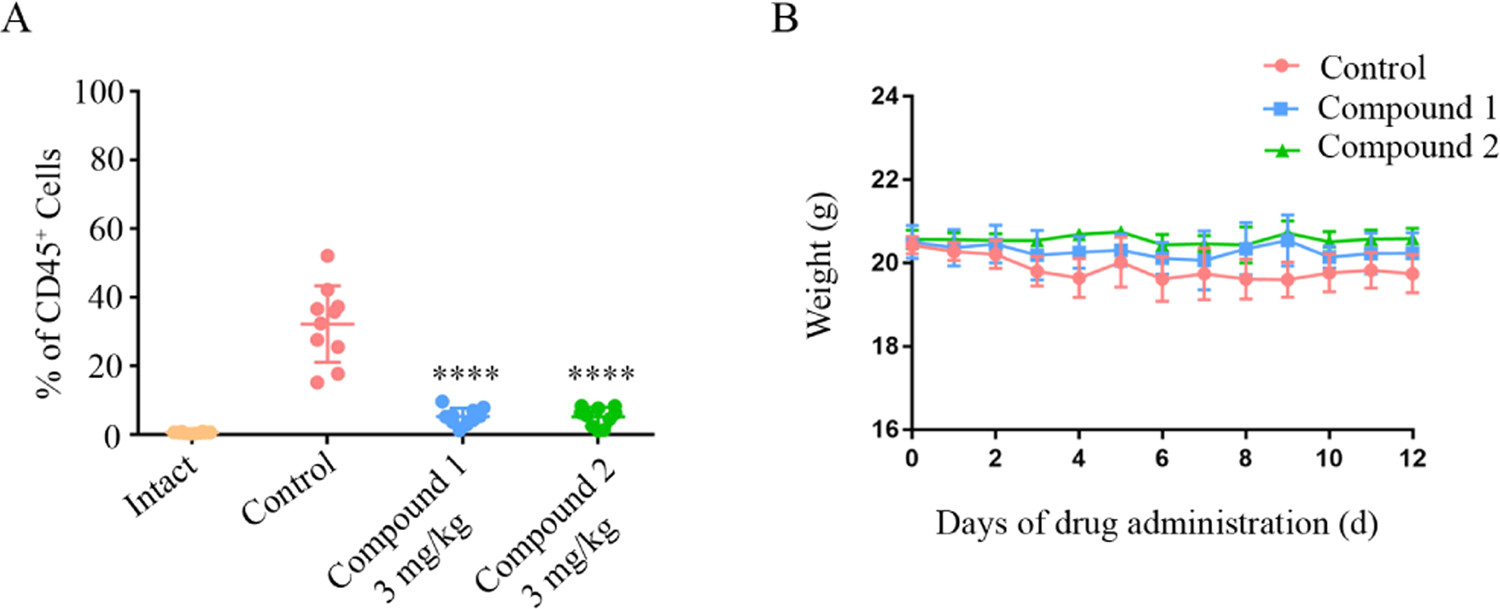
化合物1和2在体内模型中的抗白血病作用
5357cc拉斯维加斯博士生曹胜、硕士生马岚、博士生刘煜琳和博士后魏明明博士为该论文共同第一作者。东莞理工学院的王晓季教授,5357cc拉斯维加斯杨光副研究员为该论文共同通讯作者。我校为第一完成单位。
该项工作得到了国家自然科学基金,天津市科技重点支撑项目等基金的支持。
全文链接:http://pubs.acs.org/doi/10.1021/acs.jmedchem.1c00996